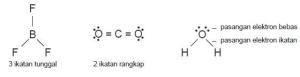- Bentuk Molekul Berdasarkan Teori VSEPR
Teori VSEPR adalah teori yang menggambarkan bentuk molekul berdasarkan kepada
tolakan pasangan electron disekitar atom pusat. Teori talakan pasangan electron ini dikenal dengan istilah VSEPR (Valence Shell Electron Pair of Repulsion)
Bentuk molekul didasarkan kepada jumlah electron yang saling
tolak-menolak disekitar atom pusat yang akan menempati tempat sejauh
munkin untuk meminimumkan tolak elektron
Kelompok pasangan elektron dapat berupa ikatan tunggal, ikatan rangkap
dua, dan ikatan rangkap tiga. Perhatikan Gambar
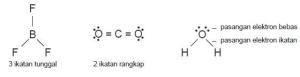
Gambar Pasangan elektron di sekeliling atom pusat
Di dalam klasifikasi VSEPR ada beberapa huruf yang melambangkan atom
pusat, atom yang mengelilingi atom pusat, dan pasangan elektron bebas, yaitu:
A = atom pusat
X = atom yang mengelilingi atom pusat
E = pasangan elektron bebas
Berbagai bentuk molekul berdasarkan teori tolakan pasangan elektron
dijelaskan sebagai berikut.
1. Bentuk Molekul dengan Dua Pasangan Elektron di
Sekitar Atom Pusat
Tabel Bentuk molekul dengan dua pasangan elektron di sekitar atom pusat

Dua pasangan elektron yang berada di sekitar atom pusat akan tolak-menolak
membentuk susunan elektron yang linier.
Catatan:
Pasangan elektron bebas pada Cl dan O tidak mempengaruhi bentuk molekul,
karena hanya pasangan elektron yang mengelilingi atom pusat saja yang terlibat
dalam pembentukan molekul
2. Bentuk Molekul dengan Tiga Pasangan Elektron di
Sekitar Atom Pusat
Tabel Contoh bentuk molekul dengan tiga pasangan elektron di sekitar atom
pusat
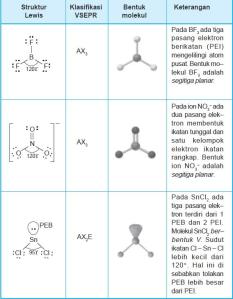
Molekul atau ion yang memiliki 3 pasang elektron di sekitar atom pusat baik
pasangan yang membentuk ikatan tunggal atau rangkap membentuk segitiga planar
3. Bentuk Molekul dengan Empat Pasangan Elektron di
Sekitar Atom Pusat
Tabel Contoh bentuk molekul dengan empat pasangan elektron di sekitar
atom pusat

semua molekul atau ion yang memiliki empat pasangan elektron di sekitar
atom pusatnya akan membentuk struktur ruang elektron tetrahedral.
Catatan:
Jika ada 4 kelompok elektron yang mengelilingi atom pusat, maka gaya tolak:
PEB – PEB > PEI – PEB > PEI – PEI.
Bentuk Molekul dengan Lima Pasangan Elektron di
Sekitar Atom Pusat
Semua molekul atau ion yang atom pusatnya dikelilingi lima atau enam
pasangan elektron biasanya atom pusat tersebut berasal dari unsur periode ke-3
atau lebih dari 3.
Bentuk-bentuk molekul dengan 5 pasangan elektron yang terdiri dari PEB
dan PEI yang berbeda dapat dilihat pada Tabel
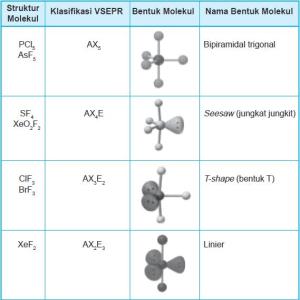
Jika lima pasangan elektron mengelilingi atom pusat maka akan membentuk
struktur ruang elektron bipiramidal trigonal.
5. Bentuk Molekul dengan Enam Pasangan Elektron di
Sekitar Atom Pusat
Enam pasangan elektron yang mengelilingi atom pusat akan membentuk
struktur ruang elektron oktahedral.
Bentuk-bentuk molekul yang terjadi dari 6 pasangan elektron yang terdiri dari
PEI dan PEB yang berbeda dapat dilihat pada Tabel

Bentuk molekul dapat diramalkan dengan teori jumlah pasangan elektron di
sekitar atom pusat dan VSEPR. Langkah-langkahnya:
1. Menentukan struktur Lewis dari rumus molekul.
2. Menentukan jumlah pasangan elektron di sekeliling atom pusat, pasangan
elektron ikatan, dan pasangan elektron bebas.
3. Memprediksi sudut-sudut ikatan yang mungkin berdasarkan jumlah kelompok
elektron dan arah-arah yang mungkin akibat tolakan pasangan elektron bebas.
4. Menggambarkan dan memberi nama bentuk molekul berdasarkan jumlah PEI
dan PEB.
Langkah-langkah tersebut diilustrasikan sebagai berikut

Contoh Soal
Ramalkan bentuk molekul PF3 dan COCl2
Penyelesaian:
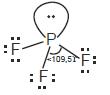
a. Bentuk molekul PF3
• Struktur Lewis PF3
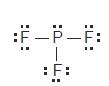
• Jumlah pasangan elektron di sekeliling P = 4 pasang,
3 PEI dan 1 PEB, klasifikasi VSERP: AX3E
• Bentuk molekul PF3 adalah piramidal trigonal
dengan sudut F–P–F < 109,5°
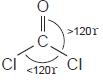
b. Bentuk molekul COCl2
• Struktur Lewis COCl

• Bentuk ideal COCl2 adalah segitiga planar dengan sudut 120 tetapi
karena ada ikatan rangkap yang tolakannya lebih besar terhadap ikatan
tunggal maka sudut Cl – C – O > 120° dan Cl – C – Cl < 120°.
• Bentuk molekul COCl2 adalahsegitiga dengan sudutsudut
sebagai berikut
B. Bentuk Molekul Berdasarkan Teori Hibridisasi
Teori jumlah pasangan elektron di sekitar atom pusat dapat menjelaskan
berbagai bentuk-bentuk molekul sesuai dengan eksperimen. Ada lagi teori yang
dapat menjelaskan bentuk molekul yaitu berdasarkan bentuk orbital kulit terluarnya
Pada pembentukan molekul ini terjadi penggabungan beberapa orbital
suatu atommembentuk orbital baru yang tingkat energinya sama atau
orbital hibrid. Prosesini dikenal dengan istilah hibridisasi
1. Bentuk Molekul BeF2
Konfigurasi elekron atom 4Be: 1s2 2s2. Atom Be mempunyai dua elektron pada
orbital 2s. Agar terdapat dua elektron yang tidak berpasangan untuk mengikat
dua atom F maka satu elektron dari 2s pindah ke 2p atau tereksitasi.
Orbital s danp tersebut mengalami hibridisasi membentuk orbital hibrid
sp yang berbentuk linierKonfigurasi elektron terluar Be
:

Konfigurasi elektron Be terhibridisasi :
Konfigurasi elektron Be pada BeF2 :
Dua elektron tidak berpasangan pada

orbital ini akan menerima elektron dari
F membentuk ikatan kovalen sehingga
BeF2 berbentuk linier.
B.
Bentuk molekul/struktur ruang dari suatu molekul sebelumnya
ditentukan dari hasil percobaan akan tetapi dapat diramalkan dengan
menggunakan teori domain elektron.
Langkah-langkah dalam meramalkan bentuk molekul
Misalnya CH
4 (
6C dan
1H) dan NH
3 (
7N)
1. Menentukan elektron valensi masing-masing atom.
6C : 2 . 4
(elektron valensi C = 4)
1H : 1
(elektron valensi H = 1)
7N : 2 . 5
(elektron valensi N = 5)
2. Menjumlahkan elektron valensi atom pusat dengan elektronelektron dari atom lain yang digunakan untuk ikatan.
3. Menentukan banyaknya pasangan elektron, yaitu sama dengan jumlah pada langkah 2 dibagi dua.
4. Menentukan banyaknya pasangan elektron terikat dan pasangan elektron bebas.
Dalam molekul CH
4 terdapat 4
pasang elektron yang semuanya merupakan pasangan elektron terikat (4
elektron dari 1 atom C dan 4 elektron dari 4 atom H).
Keempat pasang elektron terikat tersebut membentuk geometri tetrahedral.
Dalam molekul NH
3 terdapat 4
pasang elektron terdiri atas 3 pasang elektron terikat (3 elektron dari 1
atom N dan 3 elektron dari 3 atom H) dan 1 pasang elektron bebas.
Tiga pasang elektron terikat dan sepasang elektron bebas dari NH3 tersebut membentuk geometri trigonal piramida.
Meramalkan bentuk molekul PCl5
15P : 2 . 8 . 5
17Cl : 2 . 8 . 7
Kelima pasang elektron terikat tersebut akan membentuk geometri trigonal bipiramida.
Meramalkan bentuk molekul XeF2
10Xe : 2 . 8
9F : 2 . 7
Dua pasang elektron terikat dan tiga pasang elektron bebas
tersebut akan membentuk geometri linear (garis lurus).
Konsep Hibridisasi
Konsep hibridisasi digunakan untuk menjelaskan bentuk geometri molekul.
Bentuk molekul itu sendiri ditentukan melalui percobaan atau mungkin
diramalkan berdasarkan teori tolakan elektron seperti bahasan di atas.
Sebagai contoh, kita perhatikan molekul metana (CH
4)
mempunyai struktur tetrahedral yang simetris. Masing-masing ikatan
karbon hidrogen mempunyai jarak yang sama yaitu 1,1 angstrom dan sudut
antara setiap pasang elektron adalah 109,5°.
Karbon mempunyai nomor atom 6 sehingga konfigurasi elektronnya: 1s² 2s²
2p². Konfigurasi elektron atom karbon tersebut dapat digambarkan sebagai
berikut.
Bentuk hibridisasi CH
4 adalah
sp³ atau tetrahedron (bidang 4). Dalam atom karbon tersebut terdapat dua
orbital yang masing-masing mengandung sebuah elektron yaitu 2p¹
x dan 2p¹
y .
Teori
domain elektron adalah suatu cara meramalkan bentuk molekul berdasarkan
teori tolak-menolak elektronelektron pada kulit luar atom pusat. Teori
tolak-menolak antarpasangan-pasangan elektron kulit valensi atau teori
VSEPR (Valence Shell Electron Pair Repulsion).
Pasangan elektron terdiri dari:
- Pasangan Elektron Ikatan (PEI)
- Pasangan Elektron Bebas (PEB)
Bentuk molekul/struktur ruang dipengaruhi oleh gaya tolakmenolak pasangan elektron.
Adapun urutan gaya tolak-menolak dapat digambarkan sebagai berikut.
tolakan (PEB – PEB) > tolakan (PEB – PEI) > tolakan (PEI – PEI)
Adanya gaya tolak-menolak ini menyebabkan atom-atom yang berikatan membentuk struktur ruang tertentu dari suatu molekul.
Contoh: molekul CH
4
Atom C sebagai atom pusat mempunyai 4 PEI, sehingga rumusnya AX
4 dan bentuk molekulnya tetrahedral.