PROSES PEMBENTUKAN IKATAN IONIK DAN IKATAN KOVALEN
Sebelum kita memasuki materi ikatan ionik dan kovalen, terlebih dahulu kita harus memahami apa itu ikatan kimia.
• Definisi Ikatan Kimia
Adalah ikatan yang terjadi antar atom atau antar molekul dengan cara sebagai berikut :
a) atom yang 1 melepaskan elektron, sedangkan atom yang lain menerima elektron (serah terima elektron)
b) penggunaan bersama pasangan elektron yang berasal dari masing-masing atom yang berikatan
c) penggunaan bersama pasangan elektron yang berasal dari salah 1 atom yang berikatan
Tujuan pembentukan ikatan kimia adalah agar terjadi pencapaian kestabilan suatu unsur.
Elektron yang berperan pada pembentukan ikatan kimia adalah elektron valensi dari suatu atom/unsur yang terlibat.
Salah satu petunjuk dalam

pembentukan ikatan
kimia adalah adanya 1
golongan unsur yang stabil yaitu golongan VIIIA atau golongan 18 (gas
mulia).
Maka dari itu, dalam pembentukan ikatan kimia; atom-atom akan membentuk konfigurasi elektron seperti pada unsur gas mulia.
Unsur gas mulia mempunyai elektron valensi sebanyak 8 (oktet) atau 2 (duplet, yaitu atom Helium).
Periode Unsur Nomor Atom K L M N O P
1 He 2 2
2 Ne 10 2 8
3 Ar 18 2 8 8
4 Kr 36 2 8 18 8
5 Xe 54 2 8 18 18 8
6 Rn 86 2 8 18 32 18 8
Kecenderungan unsur-unsur untuk menjadikan konfigurasi elektronnya
sama seperti gas mulia terdekat dikenal dengan istilah Aturan Oktet
o Lambang Lewis
Adalah lambang atom yang dilengkapi dengan elektron valensinya.
• Lambang Lewis gas mulia menunjukkan 8 elektron valensi (4 pasang).
• Lambang Lewis unsur dari golongan lain menunjukkan adanya elektron tunggal (belum berpasangan).
Berdasarkan perubahan konfigurasi elektron yang terjadi pada
pembentukan ikatan, maka ikatan kimia dibedakan menjadi 4 yaitu : ikatan
ion, ikatan kovalen, ikatan kovalen koordinat / koordinasi / dativ dan
ikatan logam.
Walter Kossel dan
Gilbert Lewis,
pada tahun 1916 menyatakan bahwa terdapat hubungan antara stabilnya gas
mulia dengan cara atom-atom unsur saling berikatan. Lewis mengemukakan
bahwa jumlah elektron terluar dari dua atom yang berikatan, akan berubah
sedemikian rupa sehingga susunan elektron kedua atom tersebut sama
dengan susunan elektron gas mulia.
Kecenderungan atom-atom untuk memiliki konfigurasi elektron seperti gas mulia disebut
kaidah Oktet dan
kaidah duplet. Kaidah
oktet dipenuhi apabila atom memiliki 8 elektron pada kulit terluar
sedangkan kaidah duplet dipenuhi apabila atom memiliki 2 elektron pada
kulit terluar.
Struktur Lewis dari suatu molekul adalah cara
menggambarkan bagaimana atom-atom berikatan membentuk molekul dengan
menggunakan penanda seperti noktah atau tanda “
x” untuk
mewakili elektron yang terlibat dalam pembentukan molekul. Elektron
yang terlibat ini biasanya hanya elektron valensi (elektron yang berada
di kulit terluar). Prinsip dalam menggambarkan struktur Lewis suatu
molekul adalah mengupayakan agar elektron di sekitar atom dalam setiap
molekul berjumlah delapan atau mengikuti aturan oktet. Dengan memiliki
elektron sebanyak 8 setiap atom diharapkan menjadi stabil dengan
membentuk ikatan.
Untuk itu sebelum dapat menggambar struktur
Lewis suatu molekul harus memahami bagaimana menentukan konfigurasi
elektron setiap atom. Biasanya dalam soal-soal disertai dengan data
nomor atom setiap unsur yang akan digunakan, tujuannya tidak lain agar
dapat menuliskan konfigurasi elektronnya sehingga elektron valensinya
juga dapat diketahui.
A. Ikatan Ionik
1. Pengertian ikatan ionik
Ikatan Ion =
Elektrovalen = Heteropolar
Ikatan ion adalah tidak lain hanyalah jenis pembentukan ikatan kimia
yang melibatkan transfer lengkap elektron dari satu atom ke yang lain.
Ketika atom akan kehilangan atau bertambah elektron, mereka menjadi ion
yang bermuatan berbeda atau ion bermuatan berlawanan. Ion yang diisi
kemudian tertarik terhadap satu sama lain karena gaya elektrostatik,
yang membawa ion bermuatan sebaliknya bersama-sama, sehingga membentuk
ikatan ion.
Pada
ikatan ionik, terjadi transfer
elektron dari satu
atom
ke atom lainnya. Oleh karena berpindahnya elektron, maka ada atom yang
kedapatan elektron menjadi bermuatan negatif, sedangkan atom yang
kehilangan elektron akan bermuatan positif. Jika atom ketambahan elektron, maka atom tersebut menjadi
ion negatif atau dikenal dengan istilah
anion. Sedangkan jika atom kehilangan elektron, maka atom tersebut menjadi
ion positif atau
kation.
Karena adanya perbedaan muatan antar ion (ion positif dan ion negatif),
maka ion positif dan negatif akan saling tarik menarik oleh gaya
elektrostatik. Kejadian inilah yang merupakan dasar dari ikatan ionik.
[
Contoh yang paling umum dari ikatan ion adalah pembentukan natrium
klorida di mana sebuah atom natrium menggabungkan dengan atom klorin.
Mari kita lihat pada konfigurasi elektronik masing-masing.
Natrium (Na): 2,8,1 dan Klorin (Cl): 2, 8, 7.
Dengan demikian, kita melihat bahwa sebuah atom klorin membutuhkan
satu elektron untuk mencapai konfigurasi terdekat yaitu gas mulia Argon
(2,8,8). Sebuah atom natrium, di sisi lain, membutuhkan untuk
menyingkirkan elektron tunggal di kulit terluar untuk memperoleh
konfigurasi terdekat mulia yaitu gas Neon (2,8).
Ikatan Ion pada Natrium klorida (NaCl)
tom natrium menyumbangkan elektron
terluar pada atom klorin, yang hanya membutuhkan satu elektron untuk
mencapai konfigurasi oktet. Ion natrium menjadi bermuatan positif karena
kehilangan elektron, sedangkan ion klorida menjadi bermuatan negatif
karena penambahan sebuah elektron tambahan. Ion yang bermuatan
berlawanan terbentuk, tertarik satu sama lain dan mengakibatkan
membentuk ikatan ion.
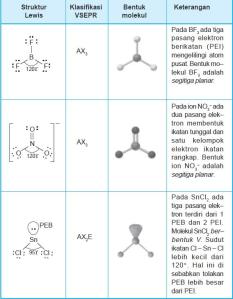
a . Ikatan ion pada 19K dan 8O dalam
K2O [1]
Konfigurasi elektron:
K : 2, 8, 8, 1 (melepas 1 elektron) membentuk
K+
O : 2, 6 (menerima 2 elektron) membentuk
O2–
2K+ + O2– → K2O
b. Ikatan ion pada Fe (elektron valensi 3) dengan Cl (elektron valensi 7) membentuk
FeCl3 [1]
Fe mempunyai elektron valensi 3 akan membentuk
Fe3+
Cl mempunyai elektron valensi 7 akan membentuk
Cl–
Fe3+ + 3Cl– → FeCl3
c. Ikatan ion antara Ca dan F [2]
Konfigurasi elektron:
Ca : 2, 7 (melepas 2 elektron) membentuk
Ca2+ (2, 8)
F : 2, 7 (menerima 1 elektron) membentuk F +
1e- (2,
8) (Catatan : Supaya persamaan reaksinya setimbang maka F ada 2
sehingga menjadi 2F, masing-masing menerima 1 elektron dari Ca)
Sehingga persamaan reaksinya menjadi :
Ca2+ + 2F– → CaF2
 |
| Perpindahan elektron dari Ca ke F. |
d. Ikatan ion antara Li dan O [2]
Konfigurasi elektron:
Li : 2, 1 (melepas 1 elektron) membentuk
Li+ (2)
O : 2, 6 (menerima 2 elektron) membentuk O +
2e- (2, 8)
Sehingga persamaan reaksinya menjadi :
2Li+ + O2– → Li
2O
 |
| Perpindahan elektron dari Li ke O. |
5. Ikatan ion antara Li dan O [2]
Konfigurasi elektron:
Al : 2, 8, 3 (melepas 3 elektron) membentuk
Al3+ (2, 8)
F : 2, 7 (menerima 1 elektron) membentuk F +
1e- (2,
8) (Catatan : Supaya persamaan reaksinya setimbang maka F ada 3
sehingga menjadi 3F, masing-masing menerima 1 elektron dari Al)
Sehingga persamaan reaksinya menjadi :
Al3+ + 3F– → AlF3

6. Ikatan antara Na dengan O
Supaya mencapai oktet, maka Na harus melepaskan 1 elektron menjadi kation Na
+
(2,8,1) (2,8)
Supaya mencapai oktet, maka O harus menerima 2 elektron menjadi anion
(2,6) (2,8)
Reaksi yang terjadi :
(x2)
(x1)
+
2 Na + O 2 Na
+ + Na
2O
Contoh lain : senyawa MgCl
2, AlF
3 dan MgO
Soal : Tentukan senyawa yang terbentuk dari :
1). Mg dengan F
2). Ca dengan Cl
3). K dengan O
Senyawa yang mempunyai ikatan ion antara lain :
a) Golongan alkali (IA) [
kecuali atom H] dengan golongan halogen (VIIA)
Contoh : NaF, KI, CsF
b) Golongan alkali (IA) [
kecuali atom H] dengan golongan oksigen (VIA)
Contoh : Na
2S, Rb
2S,Na
2O
c) Golongan alkali tanah (IIA) dengan golongan oksigen (VIA)
Contoh : CaO, BaO, MgS
2. Ciri karakteristik ikatan ion
Keberadaan ikatan ion mempengaruhi sifat kimia dan fisik dari senyawa
yang dihasilkan. Ada ada beberapa karakteristik menonjol dari ikatan
ion dan di sini adalah daftar dari beberapa karakteristik berikut:
- Karena dari kenyataan bahwa logam cenderung kehilangan elektron dan
non-logam cenderung untuk mendapatkan elektron, ikatan ion yang umum
antara logam dan non-logam. Oleh karena itu, tidak seperti ikatan
kovalen yang hanya dapat terbentuk antara non-logam, ikatan ion dapat
terbentuk antara logam dan non-logam.
- Sementara penamaan senyawa ion, nama logam selalu datang pertama dan
nama non-logam datang kedua. Misalnya, dalam kasus natrium klorida
(NaCl), natrium merupakan logam sedangkan klorin adalah non-logam.
- Senyawa yang mengandung ikatan ion mudah larut dalam air serta
beberapa pelarut polar lainnya. Ikatan ion, dengan demikian, memiliki
efek pada kelarutan senyawa yang dihasilkan.
- Ketika senyawa ion dilarutkan dalam pelarut untuk membentuk larutan homogen, larutan cenderung untuk menghantarkan listrik.
- Ikatan ion memiliki efek pada titik leleh senyawa juga, karena
senyawa ion cenderung memiliki titik leleh yang lebih tinggi, yang
berarti bahwa ikatan ion tetap stabil untuk rentang suhu yang lebih
besar.
3. Kegunaan ikatan ionik
- Ikatan ionik terbentuk antara ion logam (ion positif) dan ion non-logam (ion negatif).[1]
- Penamaan ikatan ionik sederhana dimulai dari nama logam, kemudian diikuti nama non-logam penyusunnya. Contohnya: natrium klorida.[1]
- Ikatan ionik mudah larut dalam air dan pelarut polar lainnya.[1]
- Senyawa ionik mudah sekali menghantarkan listrik jika dalam larutan.[1]
- Senyawa ionik cenderung membentuk kristal solid dengan titik leleh yang tinggi.[1]
B. Ikatan Kovalen
1. Pengertian Ikatan Kovalen
Ikatan kovalen adalah ikatan yang
terjadi antara unsur nonlogam dengan unsur nonlogam yang lain dengan
cara pemakaian bersama pasangan elektron. Adakalanya dua atom dapat
menggunakan lebih dari satu pasang elektron. Apabila yang digunakan
bersama dua pasang atau tiga pasang maka akan terbentuk ikatan kovalen
rangkap dua atau rangkap tiga. Jumlah elektron valensi yang digunakan
untuk berikatan tergantung pada kebutuhan tiap atom untuk mencapai
konfigurasi elektron seperti gas mulia (kaidah duplet atau oktet).
Penggunaan bersama pasangan elektron
digambarkan oleh lewis menggunakan titik elektron. Rumus lewis merupakan
tanda atom yang disekelilingnya terdapat titik, silang atau bulatan
kecil yang menggambarkan elektron valensi atom yang bersangkutan.
2. Sifat-sifat senyawa kovalen
- Pada suhu kamar umumnya berupa gas (misal H2, O2, N2, Cl2, CO2), cair (misalnya H2O dan HCl), ataupun berupa padatan.
- Titik didih dan titik lelehnya rendah, karena gaya tarik menarik antar molekulnya lemah meskipun ikatan antar atomnya kuat.
Larut dalam pelarut non polar dan beberapa diantaranya dapat berinteraksi dengan pelarut polar.
- Larutannya dalam air ada yang menghantarkan arus listrik (misal HCl)
tetapi sebagian besar tidak dapat menghantarkan arus listrik, baik
padatan, leburan, ataupun larutannya.
Ikatan kovalen terjadi akibat atom yang
akan berikatan tidak mampu melepaskan elektron, hal ini disebabkan
ikatan kovalen terbentuk dari unsur-unsur yang memiliki afinitas
elektron tinggi dan perbedaan keelektronegatifannya kecil.
Pembentukan ikatan kimia terbentuk dari
atom-atom unsur yang memiliki afinitas elektron tinggi serta beda
keelektronegatifannya lebih kecil dibandingkan ikatan ion. Atom non
logam cenderung untuk menerima elektron sehingga jika tiap-tiap atom non
logam berikatan maka ikatan yang terbentuk dapat dilakukan dengan cara
mempersekutukan elektronnya dan akhirnya terbentuk pasangan elektron
yang dipakai secara bersama. Pembentukan ikatan kovalen dengan cara
pemakaian bersama pasangan elektron tersebut harus sesuai dengan
konfigurasi elektron pada unsur gas mulia yaitu 8 elektron (kecuali He
berjumlah 2 elektron). Ikatan kovalen Berdasarkan jumlah pasangan
elektron yang digunakan untuk berikatan ikatan kovalen dapat dibagi
menjadi 3 jenis yaitu:
- Ikatan kovalen yang paling umum adalah ikatan kovalen tunggal dengan
hanya satu pasang elektron yang terbagi di antara dua atom. Ia biasanya
terdiri dari satu ikatan sigma. Semua ikatan yang memiliki lebih dari
satu pasang elektron disebut sebagai ikatan rangkap atau ikatan ganda.
- Ikatan yang berbagi dua pasangan elektron dinamakan ikatan kovalen
rangkap dua biasanya terdiri dari satu ikatan sigma dan satu ikatan pi.
Contohnya pada etilen(CH2CH2).
- Ikatan yang berbagi tiga pasang elektron dinamakan ikatan kovalen
rangkap tiga biasanya terdiri dari satu ikatan sigma dan dua ikatan pi.
Contohnya pada hidrogen sianida (HCN). hidrogen sianida berbeda dengan
asam sianida walaupun keduanya ditulis sebagai HCN. hidrogen sianida
dapat berupa gas, cairan ataupun suatu padatan, sedngkan asam sianida
artinya berada dalam larutan atau berada dalam air.
3. Ikatan Kovalen Tunggal
Ikatan kovalen tunggal adalah ikatan yang terbentuk dari penggunaan bersama sepasang elektron (setiap atom memberikan saham satu elektron untuk digunakan bersama).
Contoh pembentukan ikatan kovalen tunggal pada HCl
Atom H dapat berikatan kovalen dengan Cl membentuk HCl.
Perhatikan konfigurasi elektron atom H dan Cl berikut.
1H = 1 dan 17Cl = 2 8 7
Agar elektron valensi atom H mirip
dengan atom He (2) maka diperlukan satu elektron. Demikian pula atom Cl,
agar mirip dengan konfigurasi elektron atom Ar (2 8 8), diperlukan satu
elektron. Oleh karena kedua atom tersebut masing-masing memerlukan satu elektron maka
cara yang paling mungkin adalah setiap atom memberikan satu elektron
valensi untuk membentuk sepasang elektron ikatan. Perhatikan gambar
pembentukanikatan kovalen tunggal pada molekul HCl.
Gambar Pembentukan Ikatan Kovalen Tunggal Pada Molekul HCL
Sepasang elektron valensi yang digunakan bersama membentuk ikatan kovalen, dinyatakan dengan rumus titik elektron.
Contoh Pembentukan Ikatan Kovalen Tunggal Pada CH4:
Tuliskan pembentukan ikatan kovalen tunggal antara atom C dan H dalam molekul CH4.
Jawab
Konfigurasi elektron atom 1H = 1.
Konfigurasi elektron atom 6C = 2 4.
Atom C akan stabil jika mengikat empat
elektron membentuk konfigurasi mirip dengan atom Ne(2 8). Empat elektron
ini dapat diperoleh dengan cara menyumbangkan empat atom H. Jadi,
setiap atom H memberikan saham 1 elektron valensinya. Proses pembentukan
ikatan antara atom C dan H dapat dijelaskan sebagai berikut:
Gambar Pembentukan Ikatan Kovalen Tunggal Pada Molekul CH4
Pada CH4, setiap atom H memiliki 2
elektron valensi (seperti He) dan atom C memiliki 8 elektron valensi
(seperti Ne). Dalam molekul CH4 terdapat 4 pasang elektron ikatan atau 4
ikatan kovalen tunggal. Sepasang elektron ikatan dapat dinyatakan
dengan satu garis. Misalnya, pada molekul HCl, sepasang elektron ikatan
dapat dituliskan dalam bentuk H–Cl. Pada molekul CH4, keempat pasang elektron ikatan dapat dituliskan dalam bentuk seperti ditunjukkan pada Gambar berikut.
Gambar Garis Yang Menyatakan Pasangan Elektron Ikatan.
4. Ikatan Kovalen Rangkap Dua
Ikatan kovalen rangkap dua
terbentuk dari dua elektron valensi yang disahamkan oleh setiap atom
atau ikatan yang dibentuk oleh atom-atom nonlogam yang menyumbangkan dua
elektron tidak berpasangan untuk berikatan sehingga memenuhi kaidah
oktet, misalnya pada molekul O2.
Contoh pembentukan ikatan kovalen rangkap dua pada molekul O2:
Konfigurasi elektron atom Oksigen yaitu:
8O= 2 6. Atom O akan stabil jika konfigurasi elektronnya serupa dengan 10Ne=2
8. Agar stabil maka atom O memerlukan 2 elektron tambahan. Kedua
elektron ini diperoleh dengan cara patungan 2 elektron valensi dari
masing-masing atom O membentuk ikatan kovalen rangkap dua seperti gambar
berikut:
Gambar Pembentukan Ikatan Kovalen Rangkap Dua Dalam Molekul O2
Contoh Pembentukan Ikatan Kovalen Rangkap dua pada molekul CO2
Gambarkan pembentukan ikatan kovalen rangkap dua dalam molekul CO2.
Jawab
Konfigurasi elektron atom Oksigen yaitu:
8O= 2 6
Konfigurasi elektron atom karbon yaitu:
6C = 2 4
Gambar Pembentukan Ikatan Kovalen Rangkap Dua Dalam Molekul CO2
5. Ikatan Kovalen Rangkap Tiga
Ikatan kovalen rangkap tiga
adalah ikatan kovalen yang terjadi karena penggunaan bersama tiga pasang
elektron. Sejalan dengan definisi ikatan kovalen tunggal dan rangkap,
ikatan ini disebut rangkap tiga karena setip ada ikatan antar atom
melibatkan 3 pasang (6 buah) elektron valensi. Ikatan yang terbentuk
digambarkan menggunakan tiga garis lurus. Berikut proses pembentukan
ikatan kovalen rangkap 3 pada senyawa unsur N2.
Contoh Pembentukan Ikatan Kovalen Rangkap Tiga Pada Molekul N2
- Atom Nitrogen memiliki nomor atom 7 dengan konfigurasi 2,5
- Atom Nitrogen memiliki 5 elektron valensi dan guna mencapai kestabilan atomnya akan cenderung menerima 3 buah elektron.
- Ketika satu atom N berikatan dengan 1 atom sejenis maka terbentuk
satu ikatan kovalen. Masing-masing atom menyumbangkan 3 elektron untuk
digunakan bersama. Jadi ada 3 pasang (3 buah) elektron yang digunakan.
Ilustrasinya sebagai berikut.
Pada molekul N2 setiap atom N memiliki 5 elektron valensi,
maka agar diperoleh konfigurasi elektron yang stabil, setiap atom N
memerlukan tambahan elektron sebanyak 3. Untuk mengatasi kekurangan
tersebut kedua atom N yang akan berikatan masing-masing menyumbangkan 3
buah elektron, sehingga terdapat 3 pasang elektron yang digunakan
bersama.
Gambar Ikatan Kovalen Rangkap Tiga Pada Molekul N2
6. Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi adalah ikatan
yang terbentuk dari pemakaian pasangan elektron bersama yang berasal
dari salah satu atom yang memiliki pasangan elektron bebas. Contoh
senyawa yang memiliki ikatan kovalen koordinasi adalah HNO3, NH4Cl, SO3, dan H2SO4.
Ciri-ciri dari ikatan kovalen koordinasi
adalah pasangan elektron bebas dari salah satu atom yang dipakai secara
bersama-sama seperti pada contoh senyawa HNO3 berikut ini.
Contoh Pembentukan Ikatan koordinasi pada molekul HNO3
Gambar Pembentukan Ikatan Kovalen Koordinasi Pada Molekul HNO3
Dari gambar tersebut terlihat bahwa senyawa HNO3 memiliki satu ikatan kovalen koordinasi dan dua ikatan kovalen.
C. PERBEDAAN ANTARA SENYAWA ION DAN KOVALEN
No
|
Sifat
|
Senyawa Ion
|
Senyawa Kovalen
|
1
|
Titik didih
|
Tinggi
|
Rendah
|
2
|
Titik leleh
|
Tinggi
|
Rendah
|
3
|
Wujud
|
Padat pada suhu kamar
|
Padat,cair,gas pada suhu kamar
|
4
|
Daya hantar listrik
|
Padat = isolator
Lelehan = konduktor
Larutan = konduktor
|
Padat = isolator
Lelehan = isolator
Larutan = ada yang konduktor
|
5
|
Kelarutan dalam air
|
Umumnya larut
|
Umumnya tidak larut
|
6
|
Kelarutan
dalam trikloroetana (CHCl3)
|
Tidak larut
|
Larut
|



 Gaya
orientasi terjadi pada molekul-molekul yang mempunyai dipol permanen
atau molekul polar. Antaraksi antara kutub positif dari satu molekul
dengan kutub negatif dari molekul yang lain akan menimbulkan gaya
tarik-menarik yang relatif lemah. Gaya ini memberi sumbangan yang
relatif kecil terhadap gaya Van der Waals, secara keseluruhan.
Gaya
orientasi terjadi pada molekul-molekul yang mempunyai dipol permanen
atau molekul polar. Antaraksi antara kutub positif dari satu molekul
dengan kutub negatif dari molekul yang lain akan menimbulkan gaya
tarik-menarik yang relatif lemah. Gaya ini memberi sumbangan yang
relatif kecil terhadap gaya Van der Waals, secara keseluruhan.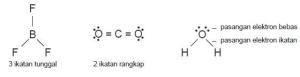






 pembentukan ikatan
pembentukan ikatan


